非平衡态热力学是热力学的一门分支,研究时变热力学系统、不可逆转变和开始系统。非平衡态热力学,和平衡态热力学相对,是研究在非零合力、流动及产生熵,但没有时间变动的隐定态中最成功的一门学科。早期所发现的非平衡态系统为BZ化学振荡器。
基本概念
平衡态热力学中基本的热力学势能为内能(U),和其变体焓(H=U+PV)、亥姆霍兹自由能(A=U-TS)或吉布斯自由能(G=U+PV-TS)。但在非平衡态热力学里,熵(S)才是最重要的。不可逆转变被静熵生成所描绘医学教育网搜集。
非平衡态热力学被用来不是热力学平衡,但可以分成足够小的系统在还够大到可以就热力学应用在它身上的子系统的研究系统上。此一假设被称为局部平衡。在某些例子中,有一堆分离的系统经由一堆分离的接连来相互作用著。连续系统则由测量每单位体积的外延量(如密度)及认为内涵量有局部定义的值来研究;这表示所有的热力学变量都可以用场来表示。内涵量的不同或梯度被称为热力学作用力,且会导致外延量的流动。
当一开放系统被允许达到一隐定态时,它会安排地让它自己达到最小的总熵值。此一被伊利亚·普里高津和其他人所重视的原理允许我们使用变分原理来公式化隐定态非平衡态热力学。另一个有力的工具为昂萨格倒易关系,它表示在两个流动至其他的不同热力学作用力的反应之间有着某些对称。
流动与力
假设熵S是一堆外延量的函数。每一个外延量有其共轭的内涵量
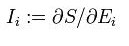
使得
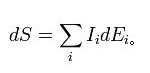
此一共轭内涵量的梯度被称为热力学作用力
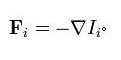 这些力会导致相对应的外延量的通量。每一个外延量都被假定是保守的。亦即下列的连续方程成立:
这些力会导致相对应的外延量的通量。每一个外延量都被假定是保守的。亦即下列的连续方程成立:
其中,是的通量密度。
若有需要,亦可以在等式右边加上一来源项。
熵生成、第二定律及昂萨格关系
由上述可知,熵的时变量为
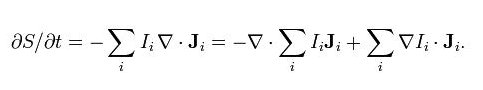
这里,Σi IiJi为一可逆的熵流动(导致熵传过系统的边界)及Σi ?Ii · Ji为主体熵生成的速率。
在此一文章中,热力学第二定律可以是指熵生成的速率必须为非负数的,即
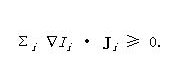
Σi ?Ii · Ji ≥ 0.不然,将可能建造出一个可能在独立系统中导致熵减少的热力学作用力和流动的情形。此一条件限制了在没有外力之下,给定一热力学作用力的流动之可能性。
在流动很小,且热力学作用力也变化地很缓慢的架构下,两者之间存在着一线性关系,可以由一标记为L的矩阵来参数化:
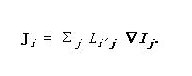
Ji = Σj Li'j ?Ij.热力学第二定律即需要矩阵L为正定矩阵。包含着力学中微观可逆生考量的统计力学意味着此一矩阵为对称矩阵。此一事实称为昂萨格倒易关系。