乙烷的分子轨域是如何形成的?
乙烷本身并不是一种特别重要的化合物,我将它包括进本页,是因为它能很好地说明碳-碳单键如何形成。
每个乙烷中的碳原子都跃迁了自己的一个电子并形成sp3杂化轨域,我们刚才已在甲烷的例子中学过sp3杂化轨域了。因此成键快开始时,原子的轨域如下图所示:

氢与两个碳原子形成分子轨域并成键,跟甲烷中的一样。两个碳原子之间通过端对端(轨域的凸部正对另一个轨域的凸部,区别于侧面对侧面)地合并剩下的sp3 杂化轨域,形成新的分子轨域来进行成键。以端对端的方式重叠而形成的成键称为σ键(读"西格玛键")。碳和氢之间的成键也是σ键。 医.学教育网搜集整理
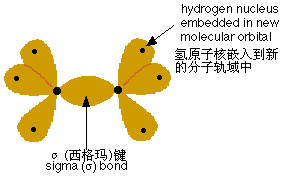
所有的σ成键中,成键电子对最易出现的那一区域无一不是位于两个原子核的连线上。
碳-碳单键的自由旋转
分子的两端可通过σ键自由地旋转,因此,从某种意义上来说,每个乙烷分子拥有无限种形状。一些可能的形状包括:

在上图几种形状的显示中,左侧的CH3基团始终维持着恒定的方位,这样更方便我们对比旋转的效果。